เซอร์ โจเซฟ จอห์น ทอมสัน
เมื่อเปรียบกับทฤษฎีอะตอมในปัจจุบัน อย่างน้อยก็มีส่วนหนึ่งของอะตอมที่ประกอบด้วยคอร์พัสเคิลหรืออนุภาคประจุลบของทอมสัน แต่ส่วนประจุบวกนั้นคำอธิบายในแบบจำลองของทอมสันยังไม่ถูกต้อง
แบบจำลองของทอมสันถูกพิสูจน์ค้านด้วยการทดลองฟอยล์ทองคำของไกเกอร์-มาร์สเดนเมื่อปี ค.ศ. 1909 ซึ่งต่อมาได้รับการตีความจาก เออร์เนสต์ รัทเทอร์ฟอร์ด ในปี ค.ศ. 1911 ว่ามีนิวเคลียสของอะตอมขนาดเล็กมากๆ บรรจุประจุบวกไว้อย่างหนาแน่น (ในกรณีของทองคำ มีประจุบวกมากพอจะรักษาสมดุลกับอิเล็กตรอน 100 ตัว) ซึ่งเป็นที่มาของแบบจำลองอะตอมของรัทเทอร์ฟอร์ด แม้ว่าทองคำจะมีเลขอะตอมเป็น 79 แต่ทันทีหลังจากที่บทความของรัทเทอร์ฟอร์ดเผยแพร่ออกมาในปี 1911 อันโตเนียส แวน เดน โบรก ก็เสนอแนวคิดทันทีว่าเลขอะตอมนั้น "เท่ากับ" จำนวนประจุนิวเคลียส ต่อมา เฮนรี มอสลีย์ทำการทดลองในปี 1913 ว่าประจุในนิวเคลียสนั้นมีค่าใกล้เคียงกับเลขอะตอมมาก (มอสลีย์พบว่ามันต่างกันแค่หน่วยเดียว) ปีเดียวกันนั้นมีการนำเสนอแบบจำลองของบอร์ ซึ่งเสนอว่านิวเคลียสนั้นบรรจุประจุบวกเป็นจำนวนเท่ากับเลขอะตอม ล้อมรอบด้วยอิเล็กตรอนจำนวนเท่ากันอยู่ในออร์บิทัล
แบบจำลองอะตอมตามทัศนะของทอมสัน
การค้นพบอิเล็กตรอน
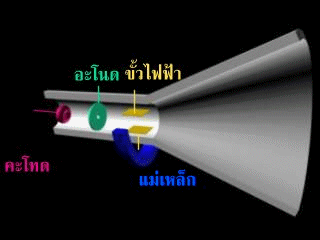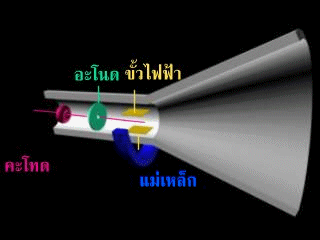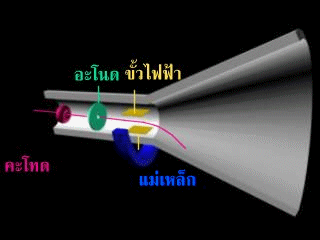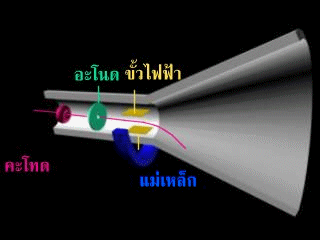
ในปี 1895 หลังจากทอมสันได้ค้นพบอิเลคตรอน(จากการหาค่าประจุต่อมวลของอนุภาคในรังสีแคโทด) และเชื่อว่าอะตอมแบ่งแยกได้ โดยมีอิเลคตรอน เป็นส่วนประกอบหนึ่งของอะตอม เซอร์โจเซฟ จอห์น ทอมสัน ดัดแปลงหลอดรังสีใหม่ ดังรูป
รังสีพุ่งจากด้าแคโทดไปยังด้านแอโนด และจะมีรังสีส่วนหนึ่งทะุลุออกไปกระทบกับฉากเรืองแสง
หลังจากนั้นทอมสันได้เพิ่มขั้วไฟฟ้าเข้าไปในหลอดรังสีแคโทดดังรูป
ปรากฎว่า รังสีนี้จะเบี่ยงเบนเข้าหาขั้วบวก แสดงว่า รังสีนี้ต้องเป็นประจุลบ แต่ไม่ทราบว่าเกิดจากก๊าซในหลอดรังสีแคโทด หรือเกิดจากขั้วไฟฟ้าทอมสันจึงทำการทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซในหลอดรังสีแคโทด พบว่า ไม่ว่าจะใช้ก๊าซใดบรรจุในหลอดหรือใช้โลหะใดเป็นแคโทด จะได้ผลการทดลองเหมือนเดิม จึงสรุปได้ว่า อะตอมทุกชนิดมีอนุภาคที่มีประจุลบเป็นองค์ประกอบ เรียกว่า "อิเล็กตรอน"
การค้นพบโปรตอน
เนื่องจากอะตอมเป็นกลางทางไฟฟ้า และการที่พบว่าอะตอมของธาตุทุกชนิดประกอบด้วยอิเล็กตรอนซึ่งมีประจุไฟฟ้าเป็นลบ ทำให้นักวิทยาศาสตร์เชื่อว่าองค์ประกอบอีกส่วนหนึ่งของอะตอม จะต้องมีประจุบวกด้วย ออยแกน โกลด์สไตน์ (Eugen Goldstein) นักวิทยาศาสตร์ชาวเยอรมัน ได้ทดลองเกี่ยวกับหลอดรังสีแคโทด โดยดัดแปลงหลอดรังสีแคโทด ดังรูป
ผลการทดลองของโกสไตน์
เมื่อผ่านกระแสไฟฟ้า ปรากฏว่ามีจุดสว่างเกิดขึ้นทั้งฉากเรืองแสง ก. และฉากเรืองแสง ข.
ไม่ได้เกิดจากขั้วไฟฟ้า
โกลสไตน์ได้อธิบายว่า จุดเรืองแสงที่เกิดขึ้นบนฉากเรืองแสง ก. จะต้องเกิดจากที่ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าบวก เคลื่อนที่ผ่านรูตรงกลางของแคโทด ไปยังฉากเรืองแสง แต่ยังไม่ทราบว่ารังสีที่มีประจุไฟฟ้าบวกนี้เกิดจากอะตอมของก๊าซ หรือเกิดจากอะตอมของขั้วไฟฟ้า และมีลักษณะเหมือนกันหรือไม่
โกลสไตน์ได้ทดลองเปลี่ยนชนิดของก๊าซในหลอดแก้วปรากฏว่าอนุภาคที่มีประจุไฟฟ้าบวกเหล่านี้มีอัตราส่วนประจุต่อมวลไม่เท่ากัน ขึ้นอยู่กับชนิดของก๊าซที่ใช้และเมื่อทดลองเปลี่ยนโลหะที่ใช้ทำเป็นขั้วไฟฟ้าหลายๆชนิดแต่ให้ก๊าซในหลอดแก้วชนิดเดียวกัน ปรากฏว่า ผลการทดลองได้อัตราส่วนประจุต่อมวลเท่ากันแสดงว่าอนุภาคบวกในหลอดรังสีแคโทดเกิดจากก๊าซ
จากผลการทดลอง ทั้งของทอมสันและโกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น จึงได้เสนอแบบจำลองอะตอม ดังนี้ อะตอมมีลักษณะเป็นทรงกลมประกอบด้วยอนุภาคโปรตอนที่มีประจุไฟฟ้าเป็นบวกและอนุภาคอิเล็กตรอนที่มีประจุไฟฟ้าเป็นลบ กระจัดกระจายอย่างสม่ำเสมอในอะตอมอะตอมที่มีสภาพเป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ
อย่างไรก็ตามแบบจำลองอะตอมของทอมสัน มีข้อบกพร่องอยู่หลาย ประการ เช่น1.ไม่สามารถอธิบายได้ว่าประจุไฟฟ้าบวกยึดกันอยู่ได้อย่างไรทั้งๆที่มีแรงผลักทางคูลอบ์มซึ่งกันและกัน
2.ไม่สามารถอธิบายการเกิดสเปกตรัมได้
3.ธาตุนีออน(Neon)ซึ่งมีอิเลคตรอน 10 ตัว ธาตุโซเดียม(Na)มีอิเลคตรอน 11 ตัวการจัดเรียงตัวของอะตอมก็น่าจะคล้ายๆกันแต่ทำไมอิเลคตรอนตัวที่ 11 ของโซเดียมจึงหลุดจากอะตอมได้ง่ายกว่าอิเลคตรอนตัวที่ 10 ของธาตุนีออน
4.อธิบายไม่ได้ว่าทำไมโซเดียมจึงทำปฏิกิริยากับธาตุอื่นๆได้ดีกว่านีออนทั้งๆที่การจัดเรียงตัวของอะตอมคล้ายๆกัน
ที่มา : http://atomic-model.blogspot.com/2010/12/blog-post_8774.html
https://th.wikipedia.org/wiki/แบบจำลองอะตอมของทอมสัน








ไม่มีความคิดเห็น:
แสดงความคิดเห็น